在制药行业中,数据完整性是确保药品质量、患者安全和合规运营的核心要素。从研发到生产,从临床试验到流通追溯,每一个环节的数据都需真实、准确、可追溯。而密码管理作为企业信息系统的“第一道防线”,直接关系到数据的访问权限与安全性。如何通过科学的密码策略满足GMP、GxP及FDA 21 CFR Part 11等法规要求?

一、 法规要求:密码管理不是“选择题”
1. FDA 21 CFR Part 11:
o §11.300:电子签名必须通过唯一标识符(如用户名+密码)验证,且需确保其安全性和不可抵赖性。
o §11.10(d):系统需通过访问控制(如密码策略)防止未经授权的操作。
2. EU GMP Annex 11:
o 附录11第6章:计算机化系统需通过权限管理(如密码控制)确保数据安全性和可追溯性。
o 附录11第9章:需记录所有用户操作,密码策略应防止非法访问和篡改。
3. WHO GMP:
o 第5章:关键系统需通过用户身份验证(如密码)保护数据完整性。
o 第17章:密码策略应防止未经授权的访问,并支持审计追踪。
4. 《药品生产质量管理规范》(GMP):
o 第163条:计算机化系统应设置操作权限管理,防止数据篡改或删除。
o 附录《计算机化系统》:用户账号需通过密码验证,且密码策略应符合数据安全要求。
5. 《药品记录与数据管理要求(试行)》(NMPA):
o 第14条:电子数据需通过权限控制(如密码)确保真实性和完整性。
o 第23条:系统需记录用户登录和操作日志,密码策略应支持审计追踪。
密码管理不仅是技术问题,更是制药企业合规的“生命线”。从FDA 21 CFR Part 11到中国GMP,法规均强调密码策略需与数据完整性目标紧密结合。
二、风险分析:从密码漏洞开始
制药企业若采用“宽松”的密码策略,可能引发以下风险:
1.账户共享与冒用:允许“多用户登录”的配置(如简单策略),易导致操作无法追溯,违反“一人一账户”的审计原则。
2.暴力破解风险:允许10次错误尝试(简单策略)远高于复杂策略的5次限制,攻击者可能通过多次试错获取权限。
3.静态密码隐患:无短信验证或双因素认证(如简单策略),仅依赖单一密码,难以抵御外来攻击。
企业需通过科学的密码配置(如复杂度、有效期、动态验证)和严格的管理制度,筑牢数据安全防线,规避因密码漏洞引发的合规风险。
三、合规密码管理:密码策略设置
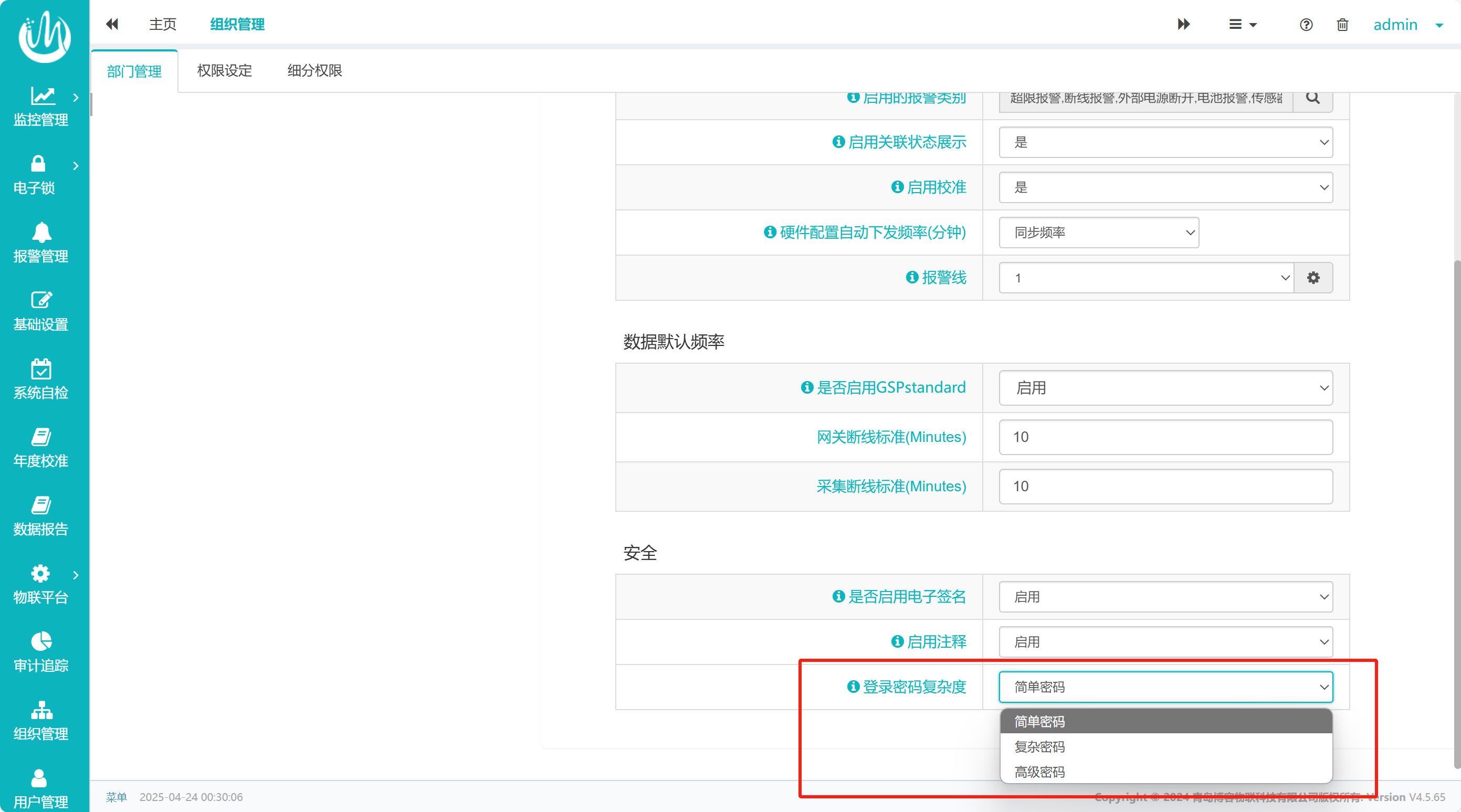
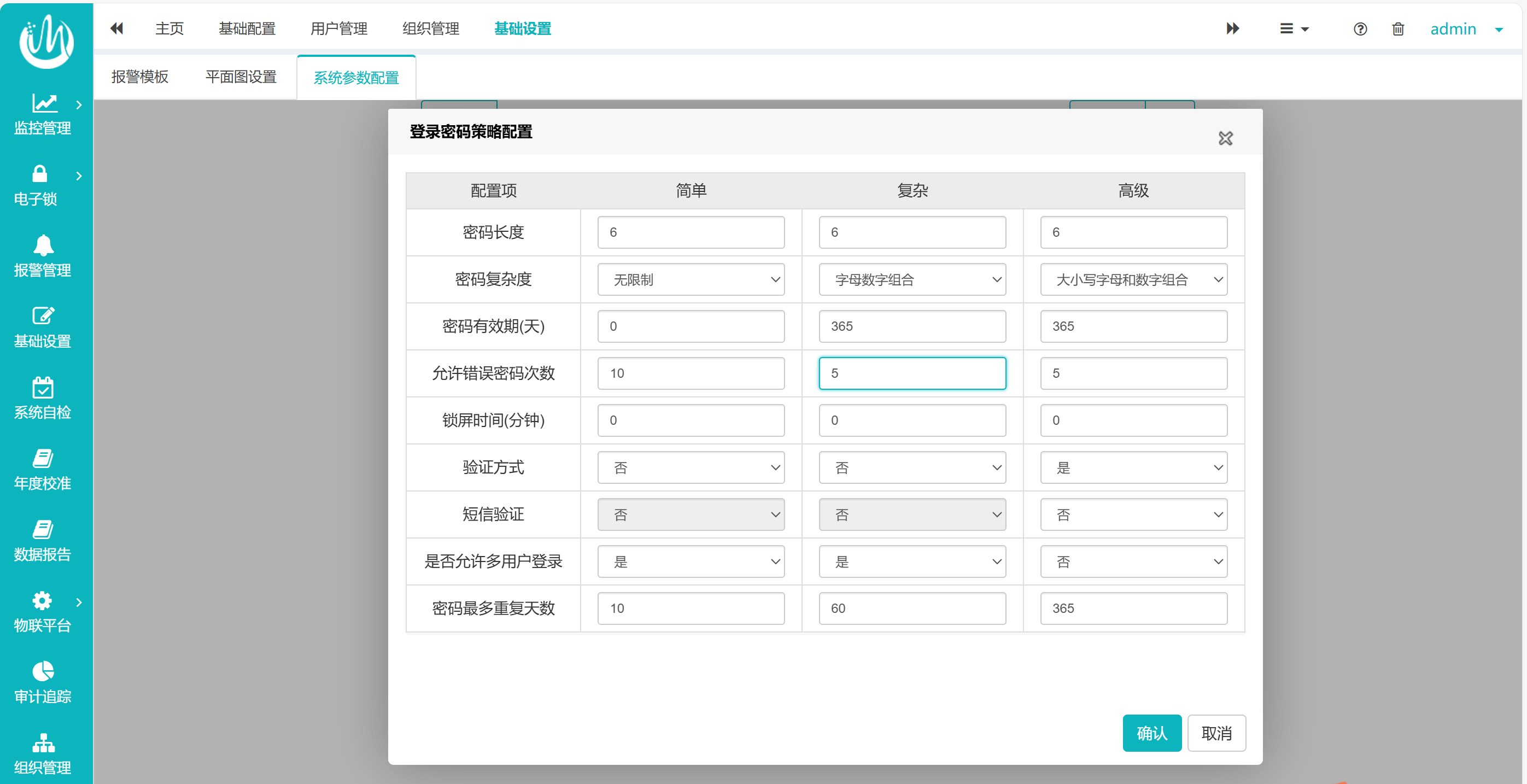
基于上述法规与风险,制药企业的计算机系统应采取严格的密码策略设置,博容Ciplelink连续监测系统可大致分为三个策略:简单、复杂、高级。具体内容建议从几个方面:
复杂度与长度:强制使用大小写字母+数字组合,长度建议延长至多位,降低密码破解风险。
允许错误次数:用户输入错误密码次数超出规定的范围后自动锁定账户,提高账户安全性。
有效期与重复限制:设置密码有效时长和密码重复周期,强制用户定期更新,降低长期暴露隐患。
动态验证:启用短信验证或生物识别,实现双因素认证,符合FDA对“可信赖系统”的要求。
权限隔离:禁止多用户登录,确保操作可追溯至具体责任人。
自动锁屏与时效:建议缩短锁屏时间,避免设备闲置时的未授权访问。
对应用于制药行业的计算机化系统满足法规要求的密码策略进行举例,此系统可根据账户级别的重要性配置不同级别的密码策略(见图1),具体的策略内容可根据用户需求自定义设置参数(见图2):
在数字化浪潮下,计算机系统的密码管理已从“技术细节”升级为制药企业合规运营的战略环节。唯有通过科学的策略配置、持续的监控优化,才能筑牢数据完整性的基石,为药品全生命周期保驾护航。从今天起,审视您的密码策略——它是否足以抵御风险?是否经得起法规考验?答案,或许就藏在每一次密码输入的细节中,博容Ciplelink连续监测:细节决定成败。
版权所有©2019青岛博容物联科技有限公司保留所有权利 鲁ICP备20030433号-1 网站地图